被质疑“无效”的国产“神药”面临退市!千万阿尔茨海默病患者重回用药困局
原创:王慧明39健康网2025-08-25 09:13:29
8月12日,国家药监局政务服务门户更新信息显示,绿谷的甘露特钠胶囊被列入“药品通知件送达信息”名单,且未附带相应审批文号。
已断货3个月的绿谷医药科技(下称“绿谷”)的甘露特钠胶囊(商品名:九期一)仍未获得批准。
8月12日,国家药监局政务服务门户更新信息显示,绿谷的甘露特钠胶囊被列入“药品通知件送达信息”名单,且未附带相应审批文号。
业内人士告诉39深呼吸,根据国内现行的新药审批流程,如果药物顺利获批会收到“药品批准证明文件送达信息”,如果收到的是“药品通知件”,则表示该产品暂未获得批准。

联想到3个月前,绿谷发布内部通知,宣布甘露特钠胶囊产品线的相关岗位停工停产。
7月中旬,直接宣布裁员80%。
种种迹象表明,17年来全球首款阿尔茨海默病新药,我国自主研发的“甘露特钠胶囊”将正式退出市场。
“甘露特钠胶囊”下架已进入倒计时!而更严峻的是,用该药已累计超过50万的阿尔茨海默病病人又该何去何从?
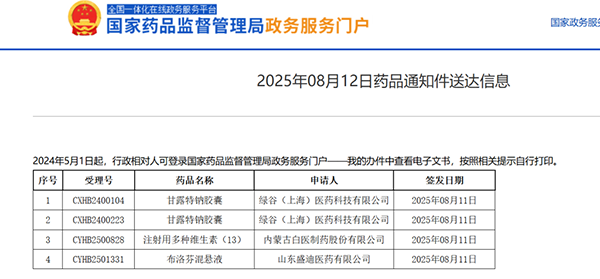
◎ 绿谷制药知名产品甘露特钠胶囊(俗称九期一),再注册申请未获批准。/ 图:国家药监局政务服务门户官网
国产希望到再注册失败:五年之期的生死赌局
8月15日晚10点,北京的李女士坐在客厅地毯上,把三个抽屉翻得乱七八糟。最后,她攥着半盒“九期一”坐在地上哭出了声——那是母亲最后三天的药量。
“我已经找遍了所有的医院和药店,但他们都告诉我已经开不出药了!”李女士的声音带着颤抖,“我妈吃了三年‘九期一’,以前虽然记不住孙子的生日,但至少能自己吃饭、认路;最近停药半个月,她连我名字都叫不全了……”
李女士的崩溃,是我国1000万阿尔茨海默病(AD)患者家庭的缩影。
作为全球AD患者最多的国家之一,我国65岁以上人群患病率已达5%,意味着每20位老人中就有1位患者。这些AD患者的记忆会像被橡皮擦一点点抹去:忘记关煤气、认不出子女、甚至失去基本生活能力。更残酷的是,AD至今无法治愈,只能通过药物延缓进展。
但长期以来,AD患者的用药选择少得可怜。2019年前,全球用于临床治疗的药物只有5款,疗效有限,且年费用超10万元,90%的患者因负担不起放弃治疗。直到“九期一”出现——这个由绿谷研发的国产原研药,终结了国内AD新药“十年空白”,并在2021年被纳入医保,价格从每盒895元降至296元.
能有效改善患者认知功能,价格也并不昂贵,很快“九期一”的用药患者累计超过50万人,仅2024年就销售超过210万盒。
然而,2025年“九期一”的药品注册证到期后一直未获再注册批准,制药工厂被迫停厂,市面上仅剩的九期一很快电商平台上的价被炒到400-5000元/盒,即便如此,李女士们的药瓶,终究还是吃空了。
国内自主研发并拥有自主知识产权的创新药,曾获得过国家重大新药创制科技重大专项支持。“九期一”的故事,被视作“中国创新药突围”的范本。

为何最终落到如此境地?
其实,“九期一”2019年是以“有条件批准”的身份上市,成为近17年全球首个获批的AD新药。所谓“有条件批准”,是当时为鼓励创新药的特殊政策——针对无药可医的疾病,允许“先上市、后验证”,但要求企业在上市后尽快完成后续研究,换取“完全批准”。
而且它的作用机制也很特别:通过重塑肠道菌群平衡,减少外周相关代谢产物的堆积,进而减轻脑内神经炎症,实现改善认知障碍的治疗效果。根据绿谷相关人士提供的中期数据分析结果:从未接受常规药物治疗的轻中度阿尔茨海默病患者,使用“九期一”单药治疗1年后,患者的认知功能分别较基线改善0.83分(ADAS-cog11量表)和0.7分(MMSE量表),日常生活能力改善2.0分(ADCS-ADL量表)。
“对当时的中国AD患者来说,‘九期一’算是‘久旱逢甘霖’。”首都医科大学附属北京天坛医院神经内科主任医师、中国老年医学会认知障碍分会副会长徐俊表示,虽然“九期一”无法彻底改善AD患者症状,但患者用后“能多记几个人名、多走几步路”,这对家庭来说就是实实在在的希望。
即便,这份希望从一开始就埋下了隐患。
“有条件批准”的宽松政策,让“九期一”避开了当时严格的“4年内完成验证”时限(现行政策要求附条件批准的药物需在4年内完成后续研究,否则退市),但它的药品注册证有效期仍为5年。2024年,“九期一”的注册证到期,绿谷提交了补充申请,却因“国际多中心三期临床试验提前终止”“长期有效性数据不足”等问题,最终未获再注册批准。
“国际多中心试验终止是关键。”一位接近国家药监局的业内人士透露,“2022年绿谷称因疫情和融资问题终止试验,但学界普遍认为,其前期数据未达到预期,继续投入风险太大。”
这一终止,直接导致“九期一”失去了换取“完全批准”的核心证据。
能否再上市?学界对它的质疑从未停止
如果只是因为临床试验周期短,导致长期有效性数据缺失,到可以通过在之后的时间里,慢慢补足数据,等待再上市。
但现在最大的问题是,该药物的作用机制从一开始就充满争议。
在阿尔茨海默病中,直到如今,大药企们的研发主流仍是基于Aβ假说,认为Aβ沉积是导致AD发生的主要触发因素。而“九期一”的治病机理则完全不同,其利用的是“脑肠轴机制”,认为AD的发生与肠道菌群有关。
这个作用机制尚未得到完全的科学验证。前首都医科大学校长饶毅就公开表示,“九期一”的所有靶标和作用都帮助治疗阿尔茨海默病,不合理,称“我从未看过一个药物有如此多的靶标共同治疗一个疾病”。
饶毅直言,“研发者耿美玉的九期一是真药的可能性小于她是中国爱因斯坦的可能性”。
除此之外,业界还认为其关键性临床试验数据存在问题。
质疑者认为,“九期一”的Ⅲ期临床仅以认知功能量表作为衡量指标,而无任何生物标志物改变来佐证变化,过于主观。
另一方面,其整体印象量表/日常生活能力两项次要终点均未达到显著差异,且并不符合多个指标相互验证的要求。

还有人指出,“‘九期一’的Ⅲ期临床试验仅进行36周,国际上普遍认为试验周期应该至少持续72周以上,因此得出的结果也并不足以令人信服。”
换句话说,如果该药物的证据链迟迟无法得到确认,意味着这个药对阿尔茨海默病患者来说就是“假药”。
在药效不明朗下,“九期一”未来是否还能获批?业内人士告诉39深呼吸,“药监的原则很明确,就是安全有效,并且希望看到更多支持材料,药物作用时间更长、样本更多等。但在这个原则之下,没办法有一个特别清晰的界限,要求补充的材料、增加的研究问题得到了什么程度才会批。‘九期一’毕竟是一个太新的药。”
一些业内人士表示,药监部门把“专业性”做为重中之重,而且在评审标准上不仅和FDA接轨,一些条件甚至“更为严格”。“对一些me- too的药,因为有很明确的机理验证,也有同类药品上市,药监局审批就比较顺利、明确,但对于一些‘first-in-class’药品,药监局就比较审慎。”
“但从绿谷近期一系列动作来看,他们自己应该也不抱太大希望了!”相关人士表示。
比“药有没有效“更重要的是“患者有没有药”
“九期一”命运恰是AD药物研发艰险的缩影。
面对AD患者的药物短缺的当下,幸运的是2024年1月,卫材的仑卡奈单抗在国内获批上市,其适应症为早期AD(轻度认知障碍或轻度痴呆阶段),需通过PET-CT或脑脊液检测确认Aβ阳性,并通过神经心理评估筛选患者。
2024年12月,礼来的多奈单抗获批上市,用于治疗成人因阿尔茨海默病(AD)引起的轻度认知功能障碍和阿尔茨海默病轻度痴呆。
目前两款进口AD类药物价格过高未大量铺开使用,但好在均已通过2025年医保目录初审。
此外根据《阿尔茨海默病药物研发管线:2025》数据显示,全球目前有182项针对AD适应症的药品临床试验正在进行,涉及138种药物。进入Ⅲ期临床试验的药物中,65%为生物靶向疗法,这其中又有60%为小分子药物。小分子药物以口服为主,可以弥补生物制剂需注射的不足,提高药物可及性和患者的依从性。
中国药企也做出了诸多努力。39深呼吸查阅数据发现,中国针对AD适应症药物研发的临床试验数量仅次于美国,排在第二位。通化金马、恒瑞医药、康诺亚、东阳光药、海正药业、先声药业、卓凯生物等多家药企在开展AD新药研发。
在研的国产AD药物中,通化金马的1.1类新药琥珀八氢氨吖啶片研发进度较为领先,2017年率先进入Ⅲ期临床。该药是中国药企自主研发的双重胆碱酯酶抑制剂,于2024年8月申报上市。据通化金马5月28日公告,该药的原料药和制剂上市申请已获国家药监局受理,后续商业化相关事宜正在筹划。
康诺亚和恒瑞医药布局的抗Aβ单抗也已经进入临床试验。其中恒瑞医药的SHR-1707已进入Ⅱ期临床试验。康诺亚的CM383正处于Ib期临床研究阶段。
在小分子口服药研发上,润佳医药自主研发的RP902(靶向神经毒性Aβ寡聚体)成为我国首个进入临床的小分子Aβ抑制剂,聚焦APOE4基因携带者这一高危人群,已进入Ⅱ/Ⅲ期临床试验。
而在中药上,康弘药业旗下治疗阿尔茨海默症(AD)的中药创新药KH110(五加益智颗粒)已进入临床III期阶段,目前处于受试者招募阶段。
另一款为北京恒清堂医药的参芪醒脑颗粒,目前处于II期临床。

李女士最近听了医生的建议,对母亲进行了多奈单抗的注射,一年药费高达20万元。她咬了咬牙,还是把钱交了上去——“哪怕只能用一年,我也想让我妈多记几天我的样子。”
但并不是每个人都能这样“放手一搏”,这或许是AD患者最残酷的生存现状:他们明知药物可能存在争议,却不得不“赌一把”;他们理解科学的严谨,却更渴望“活着”的希望。
毕竟,对1000万AD患者来说,他们等不起下一个“十年空白”。正如不少医生所说:“医学的终极目标不是征服疾病,而是让患者在剩下的日子里,有尊严地活着。” 而“活着”,至少需要一盒能买得起的药。














