广州肠癌研究又有新进展!2025年9月12日,中山大学附属第六医院肿瘤科邓艳红教授牵头开展的“新辅助特瑞普利单抗(PD-1抑制剂)联合或不联合塞来昔布(COX-2抑制剂)治疗dMMR/MSI-H局部进展期结直肠癌的II期临床试验(PICC)”五年随访结果在《柳叶刀》子刊eClinicalMedicine(IF=10)在线发表。中山六院在读博士沈旭涛、蔡月主治医师、李唯伟医师、史李铄助理研究员为论文共同第一作者,邓艳红教授胡,华斌副主任医师为共同通讯作者。

这是全球首个在dMMR/MSI-H肠癌新辅助免疫治疗领域报道的五年长期随访结果。研究结果显示,患者在接受特瑞普利单抗±塞来昔布新辅助免疫治疗后,不仅实现了高达100%的五年生存率,而且在长期随访中依然保持了出色的生活质量。这为dMMR/MSI-H局部进展期结直肠癌患者提供了一种兼顾生存与生活质量的全新治疗策略。
15%的肠癌患者对PD-1单抗高度敏感
结直肠癌是全球最常见的恶性肿瘤之一,其中约15%的患者属于“错配修复蛋白缺陷(dMMR)”或“微卫星高度不稳定(MSI-H)”亚型。由于具有高突变负荷和丰富的免疫细胞浸润,该类患者对PD-1单抗高度敏感。近年来,多项新辅助免疫治疗研究显示,dMMR/MSI-H的肠癌患者在术前接受免疫治疗可获得显著的病理缓解,但多数研究仅报道了近期疗效,长期生存获益仍缺乏可靠证据。
据了解,PICC研究是全球首个探索PD-1单药或联合塞来昔布新辅助治疗 dMMR/MSI-H 局部进展期结直肠癌的前瞻性临床试验。研究近期疗效结果已于2022年发表于 The Lancet Gastroenterology& Hepatology:联合组和单药组的病理完全缓解率(pCR)分别高达88%和65%。该成果已被《中国结直肠癌诊疗规范》、CSCO指南及美国NCCN指南引用推荐,为目前临床实践提供了重要参考。
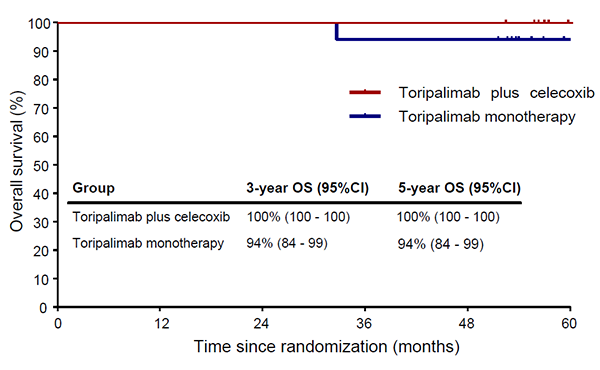
五年随访结果证实新辅助免疫治疗具有长期价值
中山六院的PICC研究此次公布的五年随访结果进一步证实了该新辅助免疫治疗方案的长期价值。接受新辅助特瑞普利单抗±塞来昔布治疗的患者均获得了显著而持久的生存获益。随访期间未见疾病复发,联合组与单药组的五年总生存率分别达到100%和94%,两组的五年癌症特异性生存率均为100%。在五年无事件生存率与无病生存率两项长期结局上,联合组均达100%,单药组均为93%,显示获益稳固。
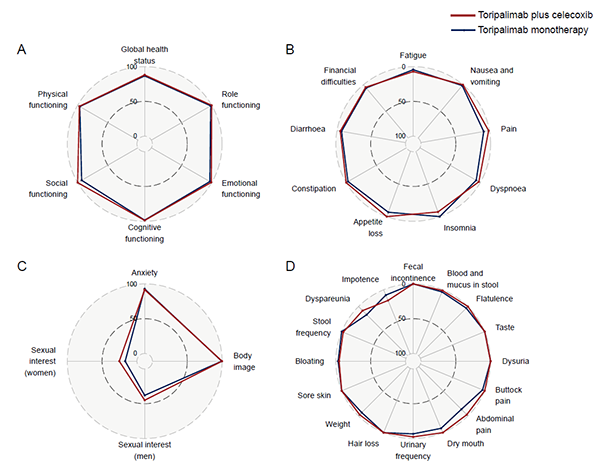
术后三年的生活质量评估显示,两组患者均报告了较高的生活质量评分(QLQ-C30、QLQ-CR29),且症状负担普遍较低。这表明,特瑞普利单抗±塞来昔布的新辅助免疫治疗方案不仅能带来卓越的长期生存获益和良好的安全性,还能够帮助患者在术后维持良好的生活质量,实现真正意义上的“长期生存与生活质量双重获益”。
该研究由中山六院肿瘤科、结直肠外科、病理科、放射诊断科、消化内镜科等多学科团队共同完成。该团队长期致力于开展以临床需求为导向的高质量临床和基础研究,并不断优化国内外指南,贡献中国智慧和方案。
(通讯员:胡华斌、刘山青、戴希安 图片:医院提供)
39健康网(www.39.net)专稿,未经书面授权请勿转载。

 39健康网
39健康网 大肠癌是不是结肠癌
大肠癌是不是结肠癌 大肠癌和肠癌一样吗
大肠癌和肠癌一样吗 大肠癌是不是结直肠癌
大肠癌是不是结直肠癌 大肠癌和直肠癌是一回事吗
大肠癌和直肠癌是一回事吗 肠癌患者是长期便血吗
肠癌患者是长期便血吗 大肠癌包括结肠癌吗
大肠癌包括结肠癌吗 盲肠癌属于大肠癌吗
盲肠癌属于大肠癌吗 肠胃的癌症有哪些种类
肠胃的癌症有哪些种类 “种植一口牙相当县城买套房” 种植牙集采要来了 能降多少?
“种植一口牙相当县城买套房” 种植牙集采要来了 能降多少? 想想都痛!女子健身房上私教课腿骨被压折,如何避免运动中受到伤害?
想想都痛!女子健身房上私教课腿骨被压折,如何避免运动中受到伤害? 武汉大学一例霍乱病例情况,霍乱是什么病?
武汉大学一例霍乱病例情况,霍乱是什么病? 还有这等好事?研究发现多照镜子或有助减肥!
还有这等好事?研究发现多照镜子或有助减肥!























