
4月22日,首个在中国开展的国外疫苗临床试验结果发布在nature medicine上。研究结果表明,辉瑞/BioNTech的BNT162b1 mRNA疫苗具有较高的安全性,并在亚洲人群中产生高水平的体液和细胞免疫应答。
该试验是在江苏省进行的一项单中心、平行分组、双盲Ⅰ期试验,研究包括144位健康中国受试者,分为年轻人(18-55岁)和老年人(65-85岁)两个年龄组。受试者按1:1的比例随机分配,分别接受10 μg或30 μg BNT162b1或安慰剂初次和加强疫苗接种,接种间隔时间为21天,评估了BNT162b1疫苗对亚洲人种的初步安全性,耐受性和免疫原性。
研究发现,大多数报道的不良反应为轻度或中度,最常见的不良反应是注射部位疼痛,发烧,头痛,疲劳,全身乏力,关节痛,肌肉疼痛和发冷。不良事件是暂时性的,可以通过简单的护理标准进行处理,也可以自发解决。大多在初次和加强免疫每次BNT162b1剂量后的7天即可缓解。
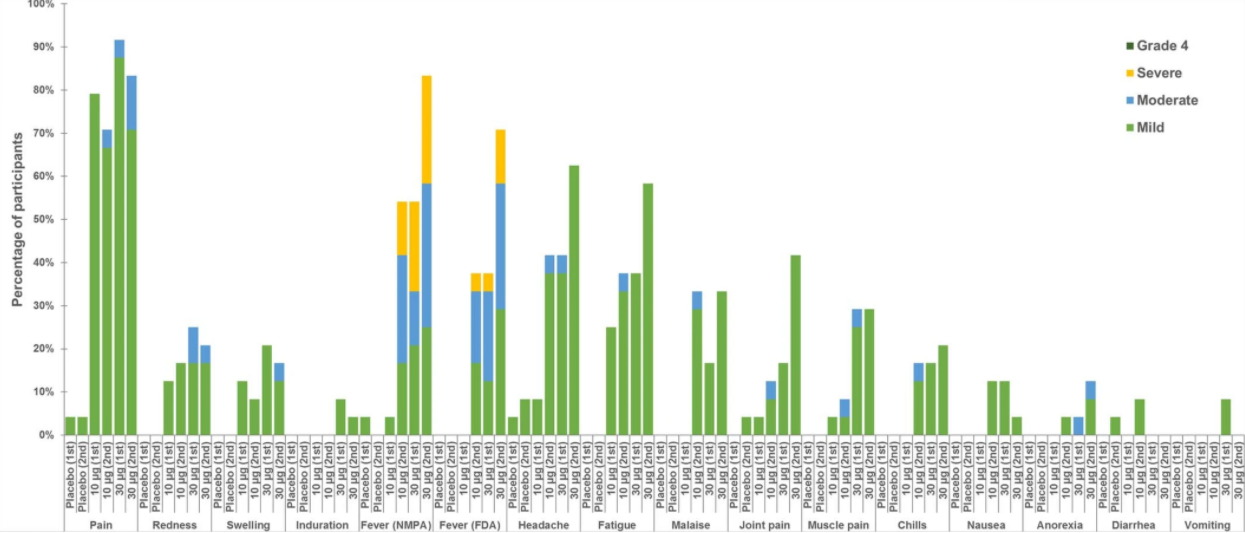
△图1 年轻人组接种BNT162b1疫苗后不良反应发生率
候选疫苗BNT162b1的初次加强免疫可有效引发特定的体液和细胞免疫反应,并且第二次疫苗接种对年轻人和老年人的抗体效价都有明显的增强作用。BNT162b1接种诱导了显著的特异性T细胞应答及IFN-γ分泌。BNT162b1接种诱导中和抗体应答显著,其中18-55岁组中,10ug和30ug接种第二次3周后,中和活性GMT为232和254;65岁以上则为80和160。而使用的对照康复者血清则为120。
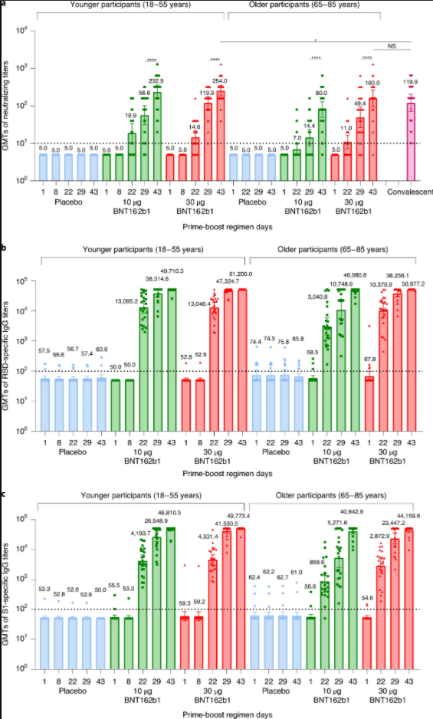
△图2 与安慰剂相比,BNT162b1诱导的50%病毒中和抗体滴度以及特异性RBD结合和S1结合抗体应答
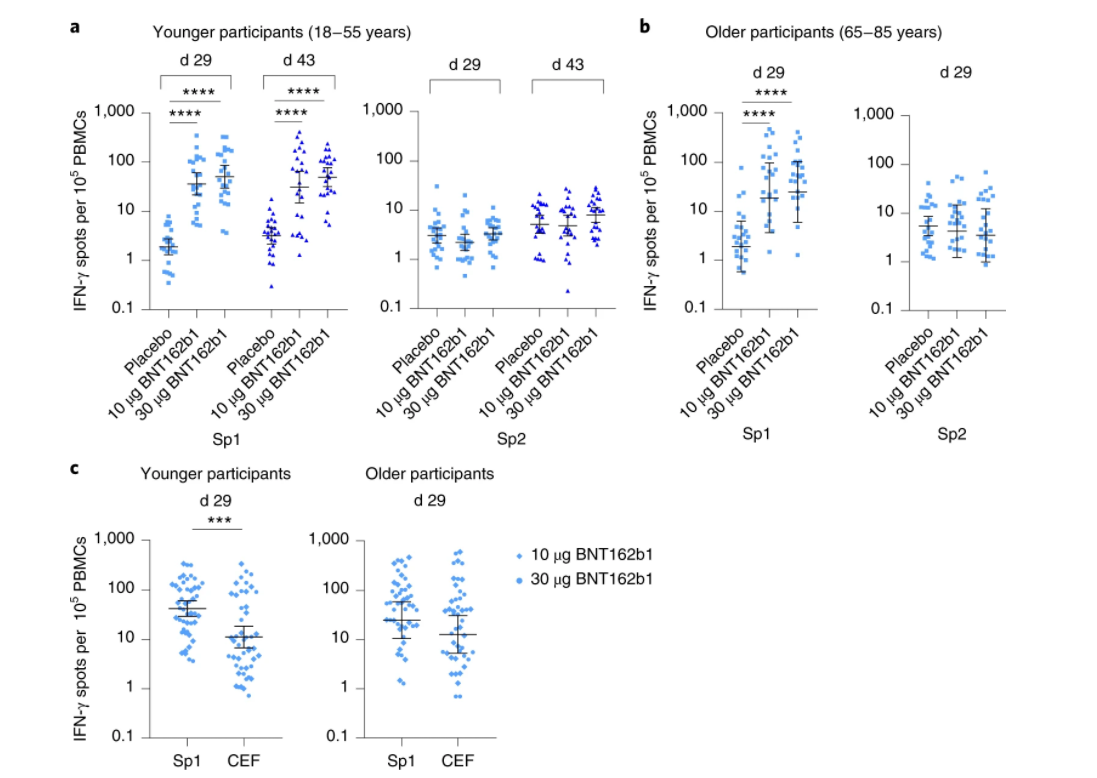
△图3 与安慰剂相比,接种疫苗的参与者中BNT162b1诱导的T细胞反应
根据这些发现,我们的数据表明,使用10 μg和30 μg BNT162b1疫苗进行初免加强免疫是安全的,并且可以在年龄较小的健康亚洲成年人(18-55岁和65-85岁)中引起强烈的体液和细胞免疫反应年龄。这一结果与之前辉瑞公布的在美国、德国的试验结果一致。
目前,针对960名18至85岁的中国成年人的BNT162b2疫苗2期临床试验也正在进行。
(资料来源:nature)
Li, J., Hui, A., Zhang, X. et al. Safety andimmunogenicity of the SARS-CoV-2 BNT162b1 mRNA vaccine in younger and olderChinese adults: a randomized, placebo-controlled, double-blind phase 1 study.Nat Med (2021). https://doi.org/10.1038/s41591-021-01330-9



