电报|2020年FDA批准的创新药物中,孤儿药资质产品占58%
2020年FDA重点放在COVID-19大流行上,但仍致力于支持罕见病治疗方法的开发。
2021-03-03

日前,FDA发表了新任局长Janet Woodcock署名文章,说明FDA如何对罕见病产品开发进行持续的支持。文中提到,2020年FDA虽然重点放在COVID-19大流行上,但依然致力于支持罕见病治疗方法的开发。
2020年,FDA批准的32种创新药物和生物制品具有孤儿药资质。在药物评估和研究中心(CDER)中,在53种创新药物批准中,有31种(占58%)是孤儿药资质产品。在CBER中,五个新的生物制品批准中的一个(占20%)是一个孤儿药资质产品,这五个批准中的另一个(尽管不是孤儿药)也适用于一种罕见病。
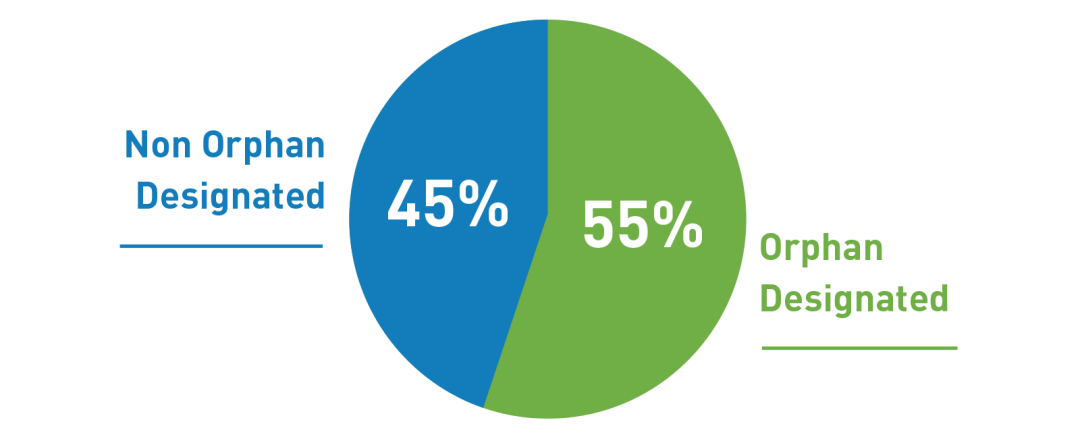
△2020年创新药物和生物制品批准情况(CBER和CDER)
除了药物和生物制品外,FDA继续关注罕见病医疗器械的开发。自1990年以来,根据“人道主义器械豁免计划”,FDA的器械与放射健康中心(CDRH)已批准了78项用于孤儿适应症的医疗器械。
从2012年到2016年,每年对孤儿药资质的申请数量一直在稳定增长,自2016年以来一直保持在每年500多个。2020年,孤儿产品开发办公室收到753个新的资质申请,比2019年增长了41%。
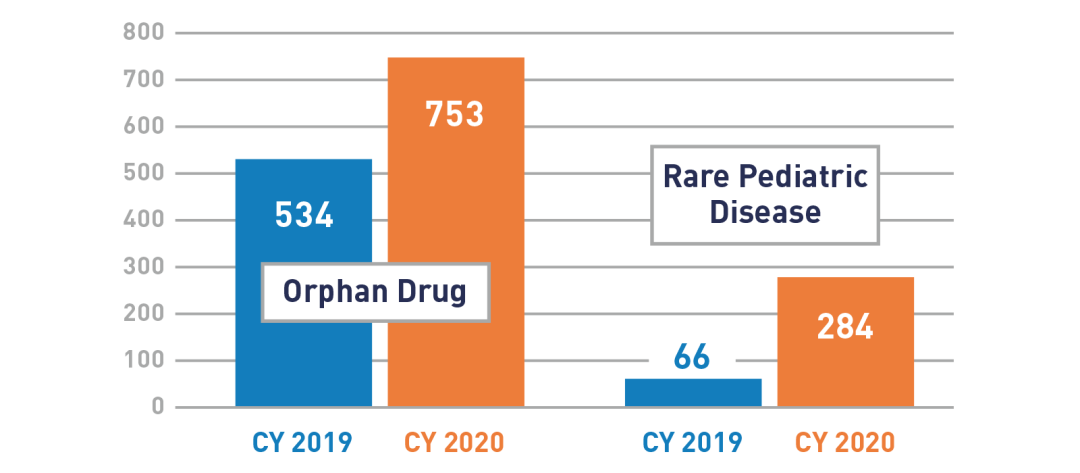
△2019/2020年收到的孤儿药和罕见儿科疾病资质申请
(资料来源:蒲公英)
shak/aa



